En 2000, la France était la 5e puissance mondiale en biologie-santé. Les prix Nobel reçus par Françoise Barré-Sinoussi et Luc Montagnier pour leurs travaux sur le virus de l'immunodéficience humaine, Jules Hoffman pour ses travaux sur le système immunitaire inné et Emmanuelle Charpentier pour le développement d'une méthode permettant de modifier le génome illustrent les contributions majeures de la France. En 2020, la France était cependant passée à la 9e place mondiale en biologie-santé. Dans les dix ans qui viennent, si les tendances actuelles se poursuivent, elle pourrait également être devancée par au moins l'Espagne et la Corée du Sud. La diminution des investissements français en biologie-santé au cours des dix dernières années, l'incapacité du pays de Pasteur à développer un vaccin contre la Covid-19 et la cacophonie des essais cliniques menés en France révèlent une crise profonde de la recherche biomédicale française. L'augmentation des financements et les réformes envisagées actuellement ne suffiront pas. Cet article explique pourquoi et propose quelques orientations pour restaurer la compétitivité de la France sur la scène internationale.
En juillet 2021, le rapport sur l'état de la recherche en biologie-santé de l'Office parlementaire d'évaluation des choix scientifiques et technologiques (OPECST) (Villani et Longuet, 2021) constatait le déclin de la production scientifique française et pointait deux faiblesses majeures de la France : un financement insuffisant et mal organisé ainsi qu'un système fragmenté et peu coordonné. Ces éléments ne sont pas nouveaux : des rapports scientifiques faisaient le même constat il y a dix ans (Enserink, 2008 ; Hassan, 2009). Depuis, le retard de la France sur la scène internationale s'est accentué.
La loi du 24 décembre 2020 de programmation de la recherche pour les années 2021 à 2030 prévoit 25 Md€ sur les dix prochaines années, l'augmentation du budget de l'Agence nationale de la recherche (ANR) de 1 Md€ d'ici à 2027 et des mesures pour renforcer l'attractivité des carrières scientifiques. En parallèle, le gouvernement a présenté la stratégie « Innovation Santé 2030 », dont l'ambition est de faire de la France la « première nation européenne innovante et souveraine en santé ». Ce plan, doté d'un budget de 7 Md€, prévoit notamment de renforcer la capacité de recherche biomédicale, d'investir dans des domaines prioritaires en biologie-santé, de simplifier le système d'autorisation des essais cliniques et de créer une nouvelle « agence de l'innovation en santé ».
En France, rares sont les études scientifiques qui utilisent les données les plus récentes et analysent la littérature internationale pour alimenter la réflexion sur la recherche en biologie-santé. Par exemple, alors que le paysage mondial de la recherche en biologie-santé s'est complètement transformé depuis 2015, le rapport de l'OPECST, cité plus haut, utilise des éléments diagnostics sur la recherche française en biologie-santé issus d'un rapport du Haut Conseil de l'évaluation de la recherche et de l'enseignement supérieur publié en 2019, mais qui limite son analyse à la période 2010-2016 (OST, 2019). Dans un contexte de compétition internationale intense, la réalisation d'un diagnostic fiable et la définition des orientations stratégiques de la politique scientifique française requièrent l'exploitation de données à jour, or les données sur les publications sont accessibles quasiment en temps réel.
Dans ce contexte, cet article analyse les données les plus récentes et la littérature internationale pour contribuer à la réflexion sur la situation de la recherche française en biologie-santé. La première partie rappelle les spécificités de la production scientifique et propose un cadre d'analyse pour évaluer la compétitivité en matière de recherche biomédicale. La deuxième partie décrit le déclin des ressources financières, humaines et matérielles consacrées à la recherche en biologie-santé au cours des dix dernières années par rapport aux pays leaders en recherche biomédicale. La troisième partie analyse le recul quantitatif et qualitatif de la production scientifique française par rapport aux autres pays. La quatrième partie analyse l'augmentation des financements et les réformes prévues dans le contexte international. La dernière partie propose quelques orientations pour accroître la valeur sociétale de la recherche biomédicale française et restaurer la compétitivité de la France sur la scène internationale.
L' évaluation de la compétitivité
en matière de recherche biomédicale
requiert un cadre d'analyse
qui prenne en compte les spécificités
de la production scientifique
Cet article analyse la recherche biomédicale comme une activité économique qui combine des ressources financières, humaines et matérielles, pour produire du savoir scientifique et des innovations. L'économie joue un rôle majeur dans la production scientifique (Stephan, 2012). En effet, l'économie étudie les coûts, les incitations et les choix d'allocation des ressources. L'activité scientifique représente des investissements majeurs. Les incitations économiques jouent un rôle prépondérant dans la production scientifique. Les choix (et les modalités) d'allocation des ressources entre différentes priorités de recherche biomédicale affectent à la fois la nature, la quantité et la qualité de la recherche biomédicale produite (Packalen et Bhattacharya, 2020).
Les ressources financières consacrées à la recherche biomédicale incluent à la fois des financements publics, nationaux et régionaux, des financements privés à but non lucratif (fondations, associations) et des financements industriels d'entreprises pharmaceutiques, biotechnologiques et d'équipements médicaux (Moses et al., 2005). Les ressources humaines incluent les chercheurs académiques, les doctorants, les chercheurs du secteur public et les chercheurs du secteur privé. Les ressources matérielles incluent les bâtiments, les équipements et le matériel des laboratoires et des centres de recherche, y compris les ressources informatiques et logicielles et les données biomédicales au sens large (données scientifiques, données de santé, données biologiques, données bio-environnementales, etc.).
L'évaluation de la production en matière de recherche biomédicale nécessite la définition de mesures quantitatives et qualitatives. La quantité de recherche produite est souvent mesurée au nombre de publications ou de brevets (Stephan, 1996 ; Jaffe et Trajtenberg, 2002). Cependant, ces indicateurs ne disent rien de la nature de la recherche produite, de sa qualité, de sa valeur sociétale ou de son potentiel économique (Aksnes et al., 2019). En ce qui concerne la nature de la recherche produite, des méthodes pour fixer des priorités de recherche en associant les médecins et les patients existent, mais ne sont que trop rarement employées (Macleod et al., 2014). En matière de qualité, il a été estimé que 85 % de l'investissement dans la recherche biomédicale internationale est gaspillé dans des études qui traitent de questions sans intérêt, utilisent des modèles d'études ou des méthodes inappropriées pour répondre à la question posée, ne sont pas publiées en entier ou sont rapportées de manière biaisée et partielle (Chalmers et Glasziou, 2009 ; Glasziou et Chalmers, 2018). La majorité des études en biologie-santé menées dans le monde ne sont pas reproductibles (Freedman et al., 2015). En matière d'essais cliniques, il a été estimé que 5,7 % des études menées dans le monde entre 1990 et 2015 utilisaient des méthodes appropriées et étaient rapportées conformément aux bonnes pratiques scientifiques, 59,3 % utilisaient des méthodes inadéquates et 42,5 % étaient rapportées de telle sorte que les méthodes ne pouvaient pas être évaluées (Catillon, 2019). La prise en compte d'indicateurs de qualité dans l'évaluation de la production scientifique biomédicale est donc cruciale.
Par nature, la recherche biomédicale produit du savoir scientifique, rendu public dans des publications à comité de lecture et des innovations protégées par des brevets. Le savoir scientifique a les caractéristiques économiques d'un « bien public » (non excluable, c'est-à-dire qu'une fois rendu public, tout le monde peut s'en servir, et non-rival, c'est-à-dire que l'utilisation par certains ne limite pas l'utilisation par d'autres). En l'absence d'incitations économiques, la production scientifique peut donc être sous-optimale du point de vue sociétal. C'est la raison pour laquelle les investissements publics y jouent un rôle majeur (Azoulay et al., 2019).
Le système scientifique récompense les chercheurs qui publient en premier (Stephan, 2012). En même temps, les inventions sont protégées par des brevets et les techniques nécessaires à la production des inventions peuvent rester secrètes. La prise en compte de ces caractéristiques du système de récompense scientifique est nécessaire à la définition des critères permettant d'évaluer la compétitivité de la France.
L es ressources financières, humaines et matérielles consacrées
à la recherche en biologie-santé
ont décliné en F rance au cours
des dix dernières années dans un contexte de compétition internationale dynamique
Les ressources financières
L'évolution des dépenses totales (publiques et privées) de recherche et développement (R&D) en France n'a pas suivi celle des grands pays de l'OCDE. Alors que la « stratégie de Lisbonne », adoptée en 2000, fixait aux pays de l'Union européenne un objectif de 3 % du PIB consacré à la dépense intérieure brute en recherche et développement (DIRD) 1 pour 2010, la DIRD française a stagné, de 2,1 % du PIB en 2000 à 2,2 % du PIB en 2010, et est restée constante jusqu'en 2019 (en pourcentage du PIB) 2 . L'évolution des ressources financières consacrées à la R&D en France et dans plusieurs pays de l'OCDE est représentée dans le graphique 1. Alors que la France était dans la moyenne de l'OCDE en 2000 (2,1 % du PIB), elle était, en 2019, en dessous de la moyenne de l'OCDE qui était alors de 2,5 % du PIB. La même année, plusieurs grands pays investissaient plus de 3 % du PIB en R&D, notamment les États-Unis, l'Allemagne et le Japon ; Israël et la Corée du Sud y consacraient même près de 5 % du PIB. De plus, la Chine, la Belgique et l'Autriche qui avaient une DIRD inférieure à celle de la France en 2000 la devançaient en 2019.
Dépenses intérieures brutes de R&D
(total ; en % du PIB ; 2000-2019)
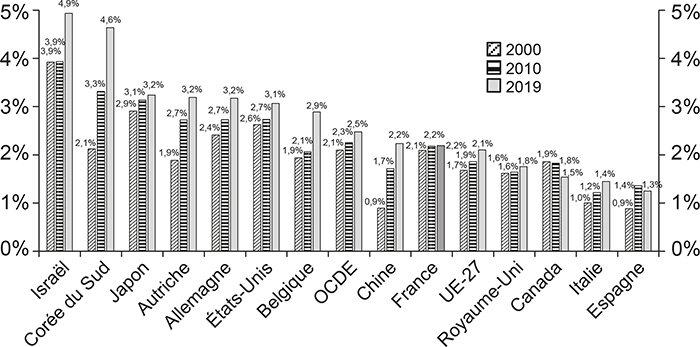
Source : OCDE (2021).
En parallèle, les financements publics consacrés à la recherche biomédicale et la proportion des dépenses publiques de recherche en biologie-santé ont diminué en France au cours des dix dernières années. La « Mission recherche et enseignement supérieur » (MIRES) du ministère de l'Enseignement Supérieur et de la Recherche représente la quasi-totalité des dépenses de recherche civile de l'état et l'essentiel des dépenses d'enseignement supérieur. La MIRES prend notamment en charge le budget de l'Institut national de la santé et de la recherche médicale (INSERM) et le budget de l'Institut national des sciences biologiques (INSB) du Centre national de la recherche scientifique (CNRS). Elle finance également l'ANR, qui constitue la source de financement quasi exclusive de la recherche sur projet. L'évolution du budget de la MIRES consacré à la biologie-santé et la part de la biologie-santé par rapport aux dépenses totales de la MIRES sont représentées dans le graphique 2 (infra). Le budget de la MIRES consacré à la biologie-santé a diminué, passant de 3 094 M€ en 2010 à 2 436 M€ en 2020 et la part biologie-santé dans le budget total est passée de 20,0 % à 17,2 % au cours de la même période. Selon le rapport des académies de médecine et de pharmacie qui cite ces chiffres : « Le pourcentage de 17,2 % que la France consacre à la recherche en biologie-santé contraste avec celui de beaucoup de pays voisins qui consacrent 35 % à 40 % de leur budget à cette recherche, et jusqu'à 50 % pour le Royaume-Uni. » (Migus et al., 2021).
Budget consacré par la MIRES à la biologie-santé de 2010 à 2020
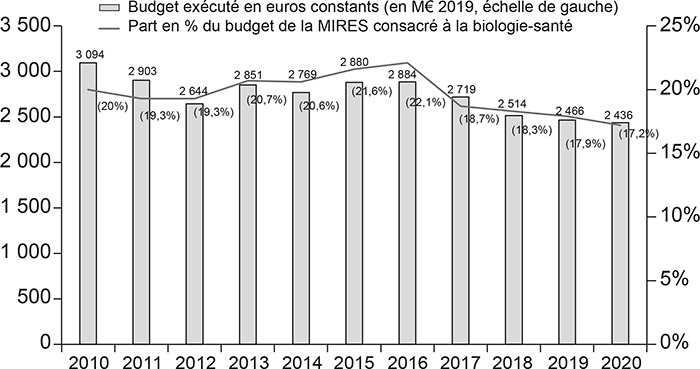
Source : Migus et al. (2021).
Les ressources humaines
Entre 2010 et 2018, le nombre total de chercheurs en France est passé de 324 551 à 429 959 (+32,5 %) et le nombre de chercheurs du secteur public est passé de 27 433 à 30 684 (+11,9 %) 3 . La croissance des effectifs observée en France au cours de cette période est légèrement supérieure à celle observée en Allemagne qui comptait, en 2019, 667 394 chercheurs (+27,9 % par rapport à 2011), dont 69 352 dans le secteur public (+7,9 % par rapport à 2011). La croissance française des effectifs de recherche est cependant inférieure à celle observée dans d'autres pays comme la Corée du Sud (+55,6 % pour les effectifs totaux et +45,9 % dans le secteur public au cours de la même période).
En ce qui concerne la nouvelle génération de chercheurs, la situation française est préoccupante. En France, entre 2010 et 2019, le nombre total de doctorants a diminué de 12,4 % et le nombre d'inscrits en première année a diminué de 14,6 %. Le nombre de diplômés est resté stable au cours de cette période (cf. graphique 3 infra). En 2019, les doctorants en biologie, médecine et santé ne représentaient que 14,4 % des effectifs totaux, les autres domaines scientifiques 38,6 %, et les sciences humaines et sociales 47,0 % 4 . À titre de comparaison, aux États-Unis, le nombre d'étudiants inscrits dans des programmes de recherche a augmenté de 9,2 % entre 2010 et 2018 et la biologie-santé représentait un quart du total des étudiants inscrits dans des programmes de recherche au cours de cette période (contre 14,4 % en France). Alors qu'en France, au cours des dix dernières années, le nombre annuel de docteurs diplômés a stagné ; aux États-Unis, dans le même temps, il a augmenté de 13,5 % 5 .
Évolution du nombre de doctorants, de primo-inscrits et de docteurs
en France, 2010-2019
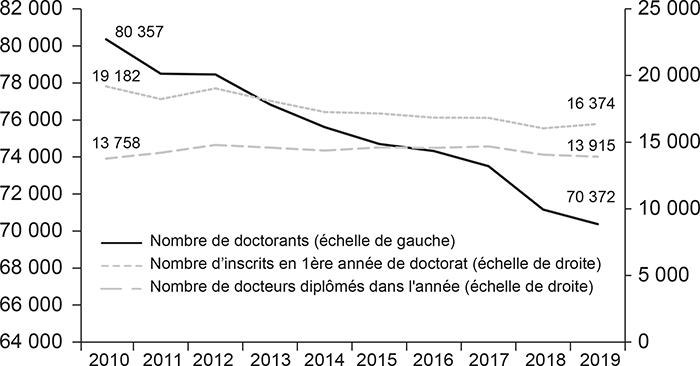
Source : MESRI-SIES, enquête sur les effectifs de doctorants et de docteurs des écoles doctorales, 2020.
La rémunération joue un rôle important dans les choix de localisation des talents scientifiques internationaux. La faible attractivité des carrières de recherche en biologie-santé en France s'explique en partie par une rémunération des chercheurs très inférieure à celle observée dans les autres grands pays producteurs de recherche. Selon l'exposé des motifs de la loi de programmation de la recherche pour les années 2021 à 2030, en début de carrière, la rémunération des scientifiques est inférieure de 37 % à la moyenne des pays de l'OCDE. Les différences de salaire avec les États-Unis, le Royaume-Uni et l'Allemagne ne font que s'accentuer au cours de la carrière (Angermuller, 2017).
Les ressources matérielles
En l'absence de données systématiques, il est difficile de dresser l'inventaire des ressources matérielles de la recherche biomédicale française pour les comparer à celles des autres pays. En France, le Pro gramme d'investissements d'avenir (PIA) constitue l'une des sources de financement des équipements en biologie-santé. Cependant, les auditions menées le 24 juin 2021 dans le cadre des travaux de l'OPECST suggèrent que la France pourrait avoir un retard important en matière d'équipements de recherche biomédicale et que les moyens disponibles ne seraient pas nécessairement alloués aux équipements les plus innovants. Par exemple, selon Arnold Migus, ancien directeur général du CNRS et membre de l'Académie nationale de médecine : « Le manque criant de crédits apparaît au niveau des équipements nécessaires en biologie-santé. L'un des exemples les plus frappants est celui des cryomicroscopes qui sont des équipements coûteux – entre 5 M€ et 10 M€ – qui ont manqué dans le cadre de la recherche sur le Covid. Nous n'en avons que trois en France, contre une cinquantaine entre l'Angleterre et l'Allemagne. » André le Bivic, directeur de l'Institut des sciences biologiques au CNRS, auditionné dans le même contexte, explique : « Nous avons dû, après le PIA qui n'avait pas financé cette technique [les cryomicroscopes] considérant qu'elle démarrait à peine, partir de zéro. Nous avons raté ce virage technologique et dû attendre sept à huit ans pour bénéficier d'un rattrapage, bien après l'ensemble de l'Europe. » (Villani et Longuet, 2021). Seule une étude scientifique des équipements de recherche biomédicaux en France et dans les grands pays de l'OCDE pourrait permettre, au-delà des anecdotes, d'établir un diagnostic de la situation française en matière d'équipements de recherche en biologie-santé.
L a production scientifique française a reculé
quantitativement et qualitativement
par rapport aux grands pays de l' OCDE
Évaluation quantitative de la recherche biomédicale française
L'évaluation quantitative ci-dessous utilise la base de données Clarivate Web of Science qui collecte, quasiment en temps réel, les données sur les publications produites dans le monde. En utilisant le nombre de publications comme indicateur de la quantité de recherche biomédicale produite, la France est passée de la 5e place en 2000, derrière les États-Unis, le Royaume-Uni, l'Allemagne et le Japon, à la 6e place en 2010 (devancée par la Chine), puis à la 9e place en 2020 (devancée par l'Italie, l'Inde et le Canada) (cf. graphique 4 infra). L’Espagne et la Corée du Sud produisent pour l'instant moins de publications que la France (respectivement 88 % et 76 % du nombre de publications françaises). Cependant, le taux de croissance du nombre de publications entre 2010 et 2020 y était respectivement de 60 % et 74 %, contre 28 % en France. Le Brésil, la Belgique, l'Autriche et Israël ont produit beaucoup moins de publications que la France en 2020 (respectivement 60 %, 33 %, 27 % et 22 %), mais ont connu, eux aussi, des taux de croissance bien supérieurs au cours des dix dernières années (respectivement 79 %, 52 %, 47 % et 41 %). Le ralentissement de la production française par rapport aux autres pays a été particulièrement marqué depuis 2015 (avec un taux de croissance de seulement 5 % sur 2015-2020). Si ces tendances se poursuivent dans les cinq à dix ans qui viennent, la France pourrait passer de la 9e à la 11e place (derrière l'Espagne et la Corée du Sud) ou même à la 12e place (derrière le Brésil).
Évolution du nombre de publications en biologie-santé
entre 2000 et 2020
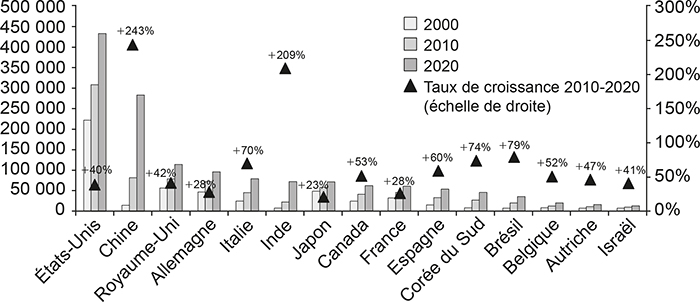
Source : Clarivate Web of Science, © Copyright Clarivate 2021 ; tous droits reservés.
Éléments qualitatifs d'évaluation
de la recherche biomédicale française
Quatre dimensions qualitatives de la recherche peuvent être mesurées objectivement : sa nature (c'est-à-dire le sujet de la recherche dans le contexte du savoir scientifique préexistant), son impact scientifique (c'est-à-dire la reconnaissance par la communauté scientifique de l'importance et de la place de la recherche par rapport aux travaux antérieurs et postérieurs), son impact pratique et économique (c'est-à-dire les innovations et les activités économiques générées par la recherche) et sa fiabilité (c'est-à-dire les caractéristiques méthodologiques qui permettent d'évaluer la solidité des conclusions de la recherche et le risque que ces conclusions puissent être contredites par des travaux postérieurs). Une évaluation complète de ces différentes dimensions de la recherche française est nécessaire pour apprécier sa compétitivité. Deux disciplines scientifiques s'intéressent particulièrement à ce type d'évaluations : la science des sciences et la métarecherche (c'est-à-dire recherche sur la recherche). Ces disciplines, qui occupent un rôle clé dans l'analyse de la production scientifique américaine, ont été peu appliquées à l'analyse de la recherche française dans le contexte du débat sur son financement et son organisation. Les quelques exemples ci-dessous illustrent certaines dimensions qualitatives qui peuvent être évaluées.
La nature de la recherche peut être évaluée à partir des données sur les publications scientifiques. Cette évaluation peut utiliser des données simples (comme les mots clés utilisés pour référencer les articles) ou plus sophistiquées (comme l'analyse du texte des articles grâce à des techniques de traitement automatique du langage naturel). Par exemple, les données de publication permettent de comparer la place de la France par rapport aux autres pays dans les applications de l'intelligence artificielle en recherche biomédicale. Le positionnement de la France en intelligence artificielle est l'une des dimensions les plus importantes pour la compétitivité de la recherche française dans les années qui viennent. En effet, l'intelligence artificielle fournit de nouveaux outils à la recherche et permet d'accroître sa productivité en automatisant de nombreuses tâches. Mais, plus important encore, elle constitue une nouvelle « méthode d'invention » qui révolutionne les processus d'innovation et l'organisation de la R&D (Cockburn et al., 2019). Le graphique 5 (infra) représente l'évolution du nombre de publications en intelligence artificielle appliquée à la médecine entre 2010 et 2020, en France et dans les grands pays producteurs de recherche. En 2020, la France se situait à la 8e place et produisait 5 % de la recherche mondiale en la matière derrière les États-Unis, la Chine, le Royaume-Uni, l'Allemagne, l'Italie, le Japon et le Canada. Elle pourrait être bientôt devancée par la Corée du Sud dont la croissance de l'activité de recherche était plus dynamique que celle de la France entre 2018 et 2020 (+410 % vs +310 %).
Recherche sur les applications de l'intelligence artificielle
en biologie-santé, 2010-2020
(nombre de publications sur les applications de l'intelligence artificielle
en biologie-santé)
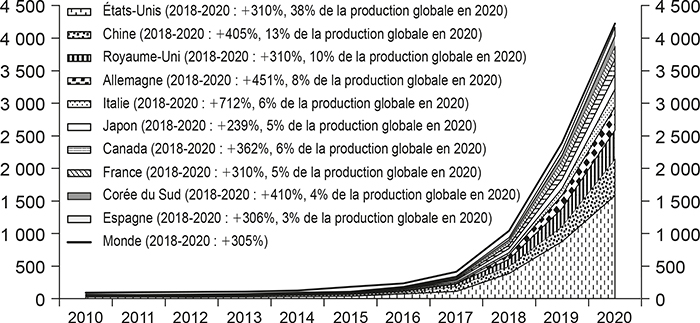
Source : Clarivate Web of Science ; © Copyright Clarivate 2021 ; tous droits reservés.
L'impact scientifique de la recherche est souvent mesuré au moyen des citations reçues par les articles scientifiques. En effet, les publications citent les articles scientifiques sur lesquels elles s'appuient pour situer leur contribution dans le paysage scientifique préexistant. Le graphique 6 (infra) présente quelques exemples d'indicateurs quantitatifs et qualitatifs relatifs à la recherche française sur la Covid-19. La France a produit 3 % des articles sur la Covid-19 produits dans le monde et 3 % du nombre global de revues de littérature (les revues de littérature sont des articles qui synthétisent le savoir existant). Ces deux indicateurs quantitatifs placent la France à la 9e place. En termes d'impact scientifique et d'influence, la France se situe à la 6e place, avec 6 % des articles les plus cités et 7 % des hot papers (ces articles sont reconnus par la communauté scientifique comme des contributions importantes très tôt après leur publication).
Indicateurs quantitatifs et qualitatifs
relatifs à la recherche sur la Covid-19 a
(en % du nombre global de publications dans chaque catégorie)
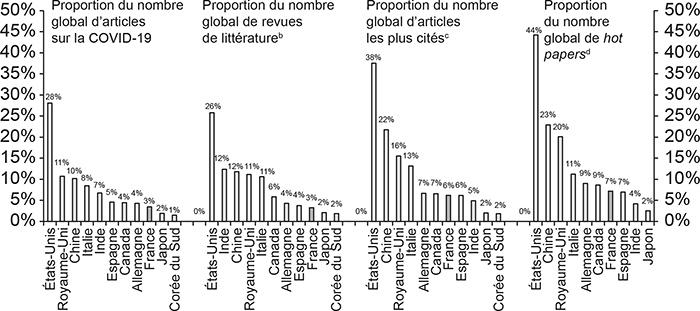
Notes :
a Requêtes Web of Science (en anglais) : TS = Covid-19 ; CU = country ; TS = Covid-19.
b Les revues de literature sont des synthèses du savoir biomédical le plus récent qui permettent à la science de progresser par accumulation.
c Les articles les plus cités sont des articles qui deviennent des « classiques » et sont encore cités plusieurs années après leur publication.
d Un petit groupe d'articles est reconnu par la communauté scientifique très tôt après leur publication, ce qui se traduit par un nombre rapide et important de citations. Ces articles sont souvent des articles clés dans leurs domaines et sont appelés articles « chauds » (hot papers).
Source : Clarivate Web of Science ; © Copyright Clarivate 2021 ; tous droits reservés.
La qualité méthodologique de la recherche biomédicale est nécessaire pour garantir la fiabilité des résultats observés. Dans le cas des essais cliniques, qui impliquent des risques pour les participants, la qualité méthodologique est également une exigence éthique, car les risques encourus par les participants ne peuvent se justifier que si le meilleur traitement n'est pas encore connu et si leur participation permet de faire avancer la science. Des consensus internationaux existent sur des critères méthodologiques qui permettent d'évaluer la fiabilité des études et leur « risque de biais » (le risque que les résultats observés ne reflètent pas l'effet véritable du traitement testé) (Catillon, 2020). Ces critères incluent notamment le nombre de participants, le processus utilisé pour répartir les participants de façon aléatoire entre le ou les traitements testés et les comparateurs (« processus de randomisation »), la conduite d'essais en aveugle afin que le patient et l’expérimentateur ne puissent pas être influencés par leurs convictions sur l’efficacité du ou des traitements testés, l'existence et l'explication des déviations par rapport aux interventions prévues dans le protocole de recherche, les méthodes statistiques utilisées pour analyser les données, le fait de rapporter les données manquantes (quand certaines données ne sont pas disponibles pour certains participants), la validité des indicateurs mesurés et des méthodes utilisées pour procéder à ces mesures et le fait de rapporter l'ensemble des résultats spécifiés à l'avance dans le protocole de recherche selon les modalités prédéfinies. L'analyse qualitative des méthodes utilisées dans les essais cliniques français dépasse le cadre de cet article. Cependant, certains éléments inclus dans le rapport de l'OPECST au sujet d'essais cliniques sur la Covid-19 laissent penser qu'une évaluation systématique de la qualité méthodologique des essais cliniques menés en France serait utile : « Un nombre impressionnant d'essais cliniques a été engagé : 365 en France contre 415 aux États-Unis, 164 en Allemagne et 140 au Royaume-Uni, et ce sans aboutir à des conclusions fiables dans la plupart des cas en raison de biais méthodologiques, notamment un nombre trop restreint de patients, gaspillant ainsi les moyens accessibles. »
L' augmentation des financements
et les réformes prévues n'apportent
qu'une réponse partielle au déclin
de la recherche biomédicale française
Les financements prévus ne sont pas à la hauteur
de ceux envisagés dans d'autres pays
La loi du 24 décembre 2020 de programmation de la recherche pour les années 2021 à 2030 prévoit l'investissement de 25 Md€ sur les dix prochaines années au profit des organismes de recherche, des universités et des établissements. L'objectif est un budget annuel de 20 Md€ en 2030 pour la recherche, soir 5 Md€ de plus qu'actuellement. De plus, les moyens de l'ANR seront augmentés de 1 Md€ d'ici à 2027. En parallèle, la stratégie « Innovation santé 2030 » prévoit 7 Md€ supplémentaires, notamment pour le renforcement de la capacité de recherche biomédicale, l'investissement dans des domaines prioritaires (biothérapies et bio production de thérapies innovantes, santé numérique et maladies infectieuses émergentes et menaces nucléaires, radiologiques, biologiques et chimiques), la simplification et l'accélération du système d'autorisation des essais cliniques et la création d'une nouvelle « Agence de l'innovation en santé » chargée de l'impulsion et du pilotage stratégique.
Cette augmentation est très en deçà des augmentations prévues dans d'autres grands pays qui investissent pourtant déjà une part supérieure de leur PIB dans la recherche. Aux États-Unis, par exemple, les budgets des National Institutes of Health, des Centers for Disease Control and Prevention et de la National Science Foundation (NSF) vont augmenter de 20 % ou plus (respectivement 21,4 %, 22,5 % et 20 %) dès 2022 par rapport à 2021(Tollefson et al., 2021).
La revalorisation des carrières
ne suffit pas à renforcer l'attractivité
de la France pour les talents internationaux
En 2021, les chargés de recherche et les maîtres de conférences nouvellement recrutés ne pourront pas être rémunérés en dessous de deux fois le salaire minimum interprofessionnel de croissance (SMIC) (contre 1,4 SMIC aujourd'hui) et bénéficieront d'un accompagnement de 10 000 euros pour démarrer leurs travaux. La rémunération des doctorants sera progressivement revalorisée de 30 %. Ces évolutions permettent de réduire le désavantage des carrières scientifiques par rapport aux autres carrières en France, mais ne permettent pas d'aligner les salaires français sur ceux proposés aux États-Unis ou en Allemagne. À l'échelle nationale, cette réforme peut permettre d'attirer davantage d'étudiants français vers les carrières scientifiques.
En ce qui concerne l'attraction des jeunes talents internationaux, en plus d'un alignement véritable des salaires sur ceux proposés dans les autres pays, d'autres mesures seraient nécessaires. Ces mesures incluent, entre autres, la facilitation du cumul de postes entre le secteur public et le secteur privé, l'augmentation de la visibilité de la recherche française sur la scène internationale, l'équipement des laboratoires avec le matériel nécessaire à la recherche biomédicale de pointe, la facilitation de la création d'entreprise et la facilitation de l'accès aux financements privés. La formation des équipes de recherche françaises dans le domaine de la culture inclusive et des biais inconscients pourrait également contribuer à aligner les pratiques sur celles des autres pays et renforcer l'attractivité de la France pour les étudiants étrangers.
L'organisation et la gouvernance de la recherche
restent complexes à cause d'une multiplicité d'acteurs
et d'un manque de coordination qui perdurent
Un rapport des Académies de médecine et de pharmacie publié en 2021 propose quatre scénarios pour réformer l'organisation de la recherche en biologie-santé : (1) la création d'un institut unique fédérant la recherche en biologie-santé qui préparerait la stratégie nationale et coordonnerait sa mise en œuvre par les organismes actuels, (2) la création au sein de l'INSERM d'un « Institut de coordination de la recherche publique en biologie-santé » avec les mêmes missions que dans le scénario précédent, (3) la mise en place d'un système analogue à l'organisation britannique où une structure unique serait chargée de la programmation, et (4) le transfert du rôle d'opérateurs de recherche des grands établissements publics vers les universités et les centres hospitaliers universitaires (CHU).
Au cours des dix dernières années, plusieurs rapports avaient déjà recommandé la simplification de l'organisation de la recherche française (Enserink, 2008 ; Hassan, 2009). En 2008, le rapport d'évaluation par l'Agence d'évaluation de la recherche et de l'enseignement supérieur (AERES) de l'INSERM, sous la direction d'Elias Zerhouni, ancien directeur des National Institutes of Health, et qui préconisait la réduction drastique de la bureaucratie et la création d'un institut national unique pour la recherche en biologie-santé, s'était heurté à la résistance des syndicats de chercheurs qui craignaient « une déstabilisation globale du système ainsi qu'une gestion trop verticale, susceptible de conduite à une perte de liberté ».
En conséquence, le rapport de l'OPECST déjà cité explique que « si le développement de ces différents scénarios offre un travail de prospective intéressant qui mériterait d'être débattu, une réforme du système de recherche ne semble pas être à l'ordre du jour. Aussi, à court terme, il convient de privilégier l'utilisation des structures existantes en optimisant les possibilités qu'elles offrent, notamment du point de vue de la coordination ». Il semble donc que la simplification de l'organisation de la recherche française en biologie-santé devra encore attendre.
Q uelques orientations pour accroître
la valeur sociétale de la recherche
biomédicale française et restaurer
la compétitivité de la F rance
sur la scène internationale
Développer la recherche française en science des sciences
et en métarecherche pour pouvoir éclairer les choix politiques
par des données issues d'études scientifiques à jour
et utilisant des méthodes appropriées
Le paysage international de la publication scientifique évolue extrêmement rapidement et les données relatives à cette évolution sont disponibles quasiment en temps réel dans plusieurs bases de données, telles que Clarivate Web of Science, dont proviennent les données bibliométriques utilisées dans cet article. Pourtant, le rapport de l'OPECST sur le financement et l'organisation de la recherche biomédicale enregistré à la présidence du Sénat le 15 juillet 2021 se fonde sur un diagnostic obsolète correspondant à la situation de la France en 2016. Entre 2016 et 2019, la France était déjà passée de la 8e à la 9e place en matière de publications en biologie-santé. Les chiffres utilisés dans le rapport de l'OPECST proviennent d'un rapport du Haut Conseil de l'évaluation de la recherche et de l'enseignement supérieur (Hcéres) publié en 2019 et intitulé Dynamics of Scientific Production in the World, in Europe and in France, 2000-2016 (Dynamique de la production scientifique dans le monde, en Europe et en France, 2000-2016). Ce rapport utilisait la même base de données que le présent article, mais limitait l'analyse de la production scientifique à la période 2000-2016. Les raisons de l'utilisation par ce rapport de données déjà obsolètes au moment de sa publication ne sont pas spécifiées.
Pour que le gouvernement puisse s'appuyer sur des études scientifiques présentant des données à jour et utilisant des méthodes appropriées, encore faut-il que de telles études existent. Si tel est le cas aux États-Unis et dans d'autres grands pays leaders en matière de recherche, ce n'est pas le cas en France. Aux États-Unis, par exemple, la NSF finance un grand programme de science des sciences intitulé « Science of Science: Discovery, Communication and Impact » 6 (Science des sciences : découvertes scientifiques, communication et impact). Ce programme vise spécifiquement à « accroître la valeur sociétale de l'activité scientifique en soutenant des projets de recherche... afin de renforcer le leadership scientifique mondial des États-Unis et de renforcer la compétitivité scientifique américaine ». En France, la science des sciences (au sens américain, avec des implications directes de politiques publiques) est quasiment inexistante. La recherche française en sciences politiques, en épistémologie ou en histoire des sciences est, comme la plupart des domaines académiques français, très éloignée de la sphère de décision politique, qui reste souvent l'apanage des énarques et autres administrateurs. Or ces derniers sont davantage formés au consensus politique et à la note de synthèse qu'à l'analyse de données scientifiques appliquée aux politiques publiques.
La France pourrait bénéficier de la mise en place d'un grand programme de recherche en science des sciences. En effet, en l'absence de données fiables et précises, il est difficile d'établir un diagnostic sur la compétitivité de la recherche française. Les grands projets américains en science des sciences, tels que le projet Innovation Measurement Initiative (IMI): Measuring the Impact of Research on Innovation, Competitiveness and Science (UMETRICS) 7 (Initiative de mesure de l'innovation : mesurer l'impact de la recherche sur l'innovation, la compétitivité et la science) permettent de suivre dans le détail l'utilisation des financements de la recherche (en personnel, équipements, matériels, contrats de sous-traitance, etc.) et de lier ces financements avec des données détaillées sur les personnels de recherche et sur l'impact scientifique et économique de la recherche (Lane et al., 2015). L'un des premiers objectifs d'un grand programme de recherche français en science des sciences pourrait être la création d'une base de données similaire, qui permettrait de suivre dans le détail l'utilisation des financements consacrés à la recherche et l'impact scientifique et économique des projets financés (afin d'en mesurer la productivité et l'impact sur la compétitivité française). Un deuxième objectif prioritaire pourrait être le lancement d'une étude nationale et internationale de collecte de données sur les ressources matérielles de la recherche en biologie-santé pour mesurer et pouvoir, le cas échéant, rattraper un éventuel retard de la France en la matière.
Fixer des obligations de résultat en termes de délais
et de coordination aux multiples agences
et organismes français investis dans le financement
et l'organisation de la recherche biomédicale
Deux ingrédients jouent un rôle majeur dans la compétitivité en matière de recherche biomédicale : le temps et les données. L'incapacité du pays à simplifier l'organisation de la recherche en réduisant le nombre d'institutions et d'agences qui y sont impliquées ne doit pas empêcher de revoir les processus administratifs et de fixer des obligations de résultat à ces institutions en matière de délais et de coordination. Comme expliqué dans la première partie de cet article, l'équipe gagnante dans la compétition scientifique internationale est celle qui publie en premier. Le terrain de recherche est international et les grandes organisations publiques ou privées qui entreprennent des projets majeurs en matière de recherche biomédicale ont la possibilité de choisir les pays dans lesquels elles collectent les données expérimentales ou observationnelles nécessaires à leurs recherches. Dans ce contexte, les lourdeurs administratives françaises qui entraînent des délais importants dans les projets de recherche menés en France en comparaison avec les autres pays pèsent fort sur la compétitivité française. Du point de vue du chercheur international, la nécessité d'interagir avec de multiples institutions françaises au lieu d'un guichet unique est un inconvénient surmontable, s'il n'augmente pas le temps requis pour accéder aux données ou aux autorisations nécessaires. En revanche, si ces multiples interactions génèrent des délais supérieurs à ceux expérimentés dans d'autres pays, ces délais peuvent menacer la possibilité de publier en premier et réduisent l'attractivité de la France en tant que terrain de recherche scientifique.
Certains projets de recherche en biologie-santé collectent leurs propres données expérimentales ou observationnelles. D'autres projets, en revanche, utilisent des données individuelles anonymisées collectées en routine par les systèmes de santé ou les assurances santé des différents pays. La France a l'atout majeur d'une base de données qui couvre 98,8 % de la population, le Health Data Hub, qui inclut les données d'assurance maladie, les données hospitalières et les données sur les causes médicales des décès. Cependant, le temps nécessaire pour accéder à ces données est de huit mois à douze mois, contre environ trois à quatre mois pour accéder à des données d'assurance santé aux États-Unis 8 ou au Japon 9 . Ces délais peuvent conduire les projets les plus innovants (et donc les plus urgents dans la course scientifique) à privilégier l'utilisation de données d'autres pays en dépit des atouts apparents des données françaises.
Développer la formation des chercheurs et des médecins
à la qualité et à la reproductibilité de la recherche
biomédicale et conditionner l'attribution de crédits
pour les essais cliniques à des critères méthodologiques
sans pour autant rallonger les délais d'attribution de ces crédits
Les chercheurs et les médecins ne peuvent garantir la qualité et la reproductibilité de la recherche biomédicale que s'ils y sont formés. Aux États-Unis, la formation à la qualité et à la reproductibilité de la recherche occupe une part croissante dans la formation des chercheurs et des médecins. Les formations sur ces sujets permettent aux médecins et aux chercheurs de devenir des consommateurs de recherche mieux informés, avec des implications importantes à la fois pour leur recherche et pour la médecine clinique.
Certains critères permettant d'évaluer la qualité des essais cliniques sont observables avant la mise en œuvre de ces essais, dans les projets ou les protocoles de recherche. En conséquence, une option possible pour améliorer la qualité des essais cliniques serait de conditionner l'attribution des crédits au respect de certains critères méthodologiques à définir. Cependant, en France, le temps requis pour obtenir les autorisations nécessaires est déjà trop long. L'incorporation de l'évaluation de critères méthodologiques devrait donc se faire sans alourdir le fardeau administratif de la recherche.
Décloisonner les disciplines de l'enseignement supérieur
Les scientifiques les plus influents sont souvent ceux qui font des liens nouveaux entre des concepts issus, parfois, de disciplines différentes (Veugelers et Wang, 2019). Dans ce contexte, le système d'enseignement supérieur français fondé, contrairement au système américain, sur des silos disciplinaires en licence ne prépare pas les étudiants à faire des découvertes majeures à l'intersection de différentes disciplines. Le système américain fondé sur des cours « à la carte » après le lycée permet de suivre en même temps, pendant les quatre ans du « Bachelor », des cours de mathématiques, d'informatique, de biologie, de neurologie, de physique, de psychologie et d'économie. Cette combinaison de disciplines qui peut, du point de vue du système d'enseignement supérieur français, paraître disparate, est pourtant optimale pour un étudiant qui souhaiterait s'orienter vers la recherche en intelligence artificielle appliquée à la santé, en neuroéconomie ou en neurobiologie des décisions. En France, un tel parcours ne serait pas possible. L'interdisciplinarité étant une caractéristique fréquente des innovations les plus influentes dans la recherche mondiale, le décloisonnement des disciplines de l'enseignement supérieur constitue donc un préalable nécessaire à la restauration de la compétitivité de la recherche française.
C onclusion
Cet article analyse les données les plus récentes et la littérature internationale pour contribuer à la réflexion sur la situation de la recherche française en biologie-santé et proposer des orientations pour restaurer la compétitivité française. Au cours des dix dernières années, par rapport aux pays leaders en recherche biomédicale, les ressources financières, humaines et matérielles consacrées à la recherche en biologie-santé en France ont décliné. La production scientifique française a également reculé, quantitativement et qualitativement par rapport aux autres pays. L'augmentation des financements et les réformes actuellement prévues ne suffiront pas à restaurer la compétitivité de la France sur la scène internationale. Cet article propose quelques orien tations pour accroître la valeur sociétale de la recherche biomédicale et restaurer la compétitivité française. Les mesures proposées incluent la mise en place d'un programme d'évaluation quantitative et qualitative de la recherche biomédicale, des obligations de résultat en termes de délais et de coordination pour les multiples agences et organismes investis dans le financement et l'organisation de la recherche biomédicale, le développement de la formation des chercheurs et des médecins à la qualité et à la reproductibilité de la recherche, le conditionnement de l'attribution des crédits pour les essais cliniques à des critères méthodologiques et le décloisonnement des disciplines dans l'enseignement supérieur.
